SBT CHƯƠNG 1: CẤU TẠO CỦA NGUYÊN TỬ
SBT CHƯƠNG 2: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN
- Giải bài tập sách bài tập (SBT) bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Giải bài tập sách bài tập (SBT) bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
- Giải bài tập sách bài tập (SBT) bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
- Giải bài tập sách bài tập (SBT) bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Giải bài tập sách bài tập (SBT) bài 9: Ôn tập chương 2
SBT CHƯƠNG 3: LIÊN KẾT HÓA HỌC
- Giải bài tập sách bài tập (SBT) bài 10 Quy tắc Octet
- Giải bài tập sách bài tập (SBT) bài 11 Liên kết ion
- Giải bài tập sách bài tập (SBT) bài 12 Liên kết cộng hóa trị
- Giải bài tập sách bài tập (SBT) Hoá 10 kết nối tri thức bài 13: Liên kết Hydrogen và tương tác Van Der Waals
- Giải bài tập sách bài tập (SBT) Hoá 10 kết nối tri thức bài 14: Ôn tập chương 3
SBT CHƯƠNG 4: PHẢN ỨNG HÓA HỌC
SBT CHƯƠNG 5: NĂNG LƯỢNG HÓA HỌC
SBT CHƯƠNG 6: TỐC ĐỘ PHẢN ỨNG
Giải bài tập sách bài tập (SBT) Hoá 10 kết nối tri thức bài 19 Tốc độ phản ứng
https://s.shopee.vn/AKN2JyAJAw
Hướng dẫn giải bài 19: Tốc độ phản ứng trang 53 sách bài tập Hoá học 10
Bài toán này thuộc chương trình sách bài tập Hoá học 10, trong bộ sách "Kết nối tri thức với cuộc sống" do Bộ giáo dục biên soạn. Bài toán giúp học sinh hiểu về tốc độ phản ứng. Việc hướng dẫn và giải bài tập chi tiết sẽ giúp học sinh nắm vững kiến thức hơn.
Bài tập và hướng dẫn giải
NHẬN BIẾT
19.1. Cho phản ứng xảy ra trong pha khí sau
H2 + Cl2 → 2HCl
Biểu thức tốc độ trung bình của phản ứng là
A. v = $\frac{\Delta C_{H_{2}}}{\Delta t}$ = $\frac{\Delta C_{Cl_{2}}}{\Delta t}$ = $\frac{\Delta C_{HCl}}{\Delta t}$.
B. v = $\frac{\Delta C_{H_{2}}}{\Delta t}$ = $\frac{\Delta C_{Cl_{2}}}{\Delta t}$ = $\frac{-\Delta C_{HCl}}{\Delta t}$.
C. v = $\frac{- \Delta C_{H_{2}}}{\Delta t}$ = $\frac{- \Delta C_{Cl_{2}}}{\Delta t}$ = $\frac{\Delta C_{HCl}}{\Delta t}$.
D. v = $\frac{- \Delta C_{H_{2}}}{\Delta t}$ = $\frac{- \Delta C_{Cl_{2}}}{\Delta t}$ = $\frac{\Delta C_{HCl}}{2\Delta t}$.
19.2. Trong dung dịch phản ứng thuỷ phân ethyl acetate (CH3COOC2H5) có xúc tác acid vô cơ xảy ra như sau:
CH3COOH + C2H5OH $\overset{HCl}{\rightarrow}$ CH3COOC2H5+ H2O
Phát biểu nào sau đây đúng?
A. Nồng độ acid tăng dần theo thời gian.
B. Thời điểm ban đầu, nồng độ acid trong binh phản ứng bằng 0.
C. Tỉ lệ mol giữa chất đầu và chất sản phẩm luôn bằng 1.
D. HCl chuyển hoá dần thành CH3COOH nên nồng độ HCl giảm dần theo thời gian.
19.3. Sục khí CO2 vào bình chứa dung dịch Na2CO3.
a) Tốc độ hấp thụ khí CO2 sẽ thay đổi như thế nào nếu thêm các chất sau đây vào dung dịch:
(i) HCl; (ii) NaCl; (iii) H₂O; (iv) K2CO3.
b) Nếu tăng áp suất, tốc độ phản ứng thay đổi như thế nào?
19.4. Cho các phản ứng hoá học sau
a) Fe3O4 (s) + 4CO (g) → 3Fe (s) + 4CO2 (g)
b) 2NO2 (g) → N2O4 (g)
c) H2 (g) + Cl2 (g) → 2HCl (g)
d) CaO (s) + SiO2 (s) → CaSiO3 (s)
e) CaO (s) + CO2 (g) → CaCO3 (s)
g) 2KI (aq) + H2O2 (aq) → I2 (s) + 2KOH (aq)
Tốc độ những phản ứng nào ở trên thay đổi khi áp suất thay đổi?
19.5. Cho bột Fe vào dung dịch HCl loãng. Sau đó đun nóng hỗn hợp này. Phát biểu nào sau đây không đúng ?
A. Khi H2 thoát ra nhanh hơn.
B. Bột Fe tan nhanh hơn.
C. Lượng muối thu được nhiều hơn.
D. Nồng độ HCl giảm nhanh hơn.
19.6. Cho phản ứng hoá học xảy ra trong pha khí sau:
N2 + 3H2 → 2NH3
Phát biểu nào sau đây không đúng?
Khi nhiệt độ phản ứng tăng lên,
A. tốc độ chuyển động của phân tử chất đầu (N2, H2) tăng lên
B. tốc độ va chạm giữa phân tử N2 và H2 tăng lên.
C. số va chạm hiệu quả tăng lên.
D. tốc độ chuyển động của phân tử chất sản phẩm (NH3) giảm.
19.7. Cho bột magnesium vào nước, phản ứng xảy ra rất chậm. Hãy nêu cách làm tăng tốc độ phản ứng trên.
19.8. Cho phản ứng hoá học sau
Zn (s) + H2SO4 (aq) → ZnSO4 (aq) + H2 (g)
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Diện tích bề mặt zinc.
B. Nồng độ dung dịch sulfuric acid.
C. Thể tích dung dịch sulfuric acid.
D. Nhiệt độ của dung dịch sulfuric acid.
19.9. Phát biểu nào sau đây là đúng về xúc tác?
A. Xúc tác giúp làm tăng năng lượng hoạt hoá của phản ứng.
B. Khối lượng xúc tác không thay đổi sau phản ứng.
C. Xúc tác không tương tác với các chất trong quá trình phản ứng.
D. Xúc tác kết hợp với sản phẩm phản ứng tạo thành hợp chất bền.
19.10. Cho phản ứng thuỷ phân tinh bột có xúc tác là HCl.
Phát biểu nào sau đây không đúng?
A. HCl không tác dụng với tinh bột trong quá trình phản ứng.
B. Nếu nồng độ HCl tăng, tốc độ phản ứng tăng.
C. Khi không có HCl, phản ứng thuỷ phân tinh bột vẫn xảy ra nhưng với tốc độ chậm.
D. Nồng độ HCl không đổi sau phản ứng.
THÔNG HIỂU
19.11. Cho các phản ứng hoá học sau
(1) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
(2) 3Fe +2O2 → Fe3O4
(3) 4K + O2 → 2K2O
(4) CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Ở điều kiện thường, phản ứng nào xảy ra nhanh, phản ứng nào xảy ra chậm?
19.12. Thả 1 mảnh magnesium có khối lượng 0,1 g vào dung dịch HCl loãng. Sau 5 giây thấy mảnh magnesium tan hết. Hãy tính tốc độ trung bình của phản ứng hoà tan magnesium.
19.13. Trong một thí nghiệm, người ta đo được tốc độ trung bình của phản ứng của zinc (dạng bột) với dung dịch H2SO4 0,005 mol/s.
Nếu ban đầu cho 0,4 mol zinc (dạng bột) vào dung dịch H2SO4 ở trên thì sau bao lâu còn lại 0,05 mol zinc.
19.14. Xét phản ứng: 3O2 → 2O3.
Nồng độ ban đầu của oxygen là 0,024 M. Sau 5 giây nồng độ của oxygen còn lại là 0,02M. Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.
19.15. Cho các phản ứng hoả học sau
a) CH3COOC2H5(l) + H2O(l) → CH3COOH(l) + C2H5OH(l)
b) Zn (s) + H2SO4 (aq) → ZnSO4 (aq) + H2 (g)
c) H2C2O4 (aq) + 2KMnO4 (aq) + 8H2SO4(aq) → 10CO2(g) + 2MnSO4 (aq) + 8H2O (l)
Tốc độ các phản ứng trên sẽ thay đổi thế nào nếu ta thêm nước vào binh phản ứng?
19.16. Thực hiện hai thí nghiệm của cùng một lượng CaCO3 với dung dịch HCl (dư) có nồng độ khác nhau. Thể tích khí CO2 thoát ra theo thời gian được ghi lại trên đồ thị sau
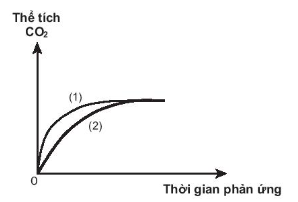
Phản ứng nào đã dùng HCl với nồng độ cao hơn?
19.17. Cho phản ứng hoá học sau: H2O2 → H2O + $\frac{1}{2}$O2
Biết rằng tốc độ của phản ứng này tuân theo biểu thức của định luật tác dụng khối lượng.
a) Hãy viết biểu thức tốc độ phản ứng.
b) Tốc độ phản ứng tức thời tăng dần hay giảm dần theo thời gian?
19.18. Cách nào sau đây sẽ làm củ khoai tây chín nhanh nhất ?
A. Luộc trong nước sôi.
B. Hấp cách thuỷ trong nồi cơm.
C. Nướng ở 180°C.
D. Hấp trên nồi hơi.
19.19. Các nhà khảo cổ thường tìm được xác các loài động thực vật thời tiền sử nguyên vẹn trong băng. Hãy giải thích tại sao băng lại giúp bảo quản xác động thực vật.
19.20. NOCl là chất khí độc, sinh ra do sự phân huỷ nước cường toan (hỗn hợp HNO3 và HCl có tỉ lệ mol 1:3). NOCl có tính oxi hoá mạnh, ở nhiệt độ cao bị phân huỷ theo phản ứng hoá học sau:
2NOCl → 2NO + Cl2
Tốc độ phản ứng ở 70°C là 2.$10^{-7}$ mol/(L·s) và ở 80°C là 4,5.$10^{-7}$ mol/(L.s).
a) Tính hệ số nhiệt độ $\gamma $ của phản ứng.
b) Dự đoán tốc độ phản ứng ở 60°C.
19.21. Khi thắng đường để làm caramen hoặc nước hàng, ta thường dùng đường kính chứ không dùng đường phèn. Giải thích.
19.22. Khi dùng MnO2 làm xúc tác trong phản ứng phân huỷ H2O2, tại sao ta cần dùng MnO2 ở dạng bột chứ không dùng ở dạng viên.
19.23. Trong công nghiệp, vôi sống được sản xuất bằng cách nung đá vôi. Phản ứng hoá học xảy ra như sau
CaCO3 → CaO + CO2
Khi nung, đá vôi cần phải được đập nhỏ nhưng không nên nghiền mịn đá vôi thành bột. Giải thích.
VẬN DỤNG
19.24. Trong quá trình tổng hợp nitric acid, có giai đoạn đốt cháy NH3 bằng O2 có xúc tác. Phản ứng xảy ra trong pha khí như sau:
4NH3 +5O2 → 4NO + 6H2O
Trong một thí nghiệm, cho vào bình phản ứng (binh kín) 560 mL khí NH3 và 672 mL khí O2 (có xúc tác, các thể tích khí đo ở đktc). Sau khi thực hiện phản ứng 2,5 giờ, thấy có 0,432 g nước tạo thành.
a) Viết biểu thức tính tốc độ trung bình của phản ứng theo các chất tham gia và chất tạo thành trong phản ứng.
b) Tính tốc độ trung bình của phản ứng theo đơn vị mol/h
c) Tính số mol NH3 và O2 sau 2,5 giờ.
19.25. Thực hiện phản ứng sau CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
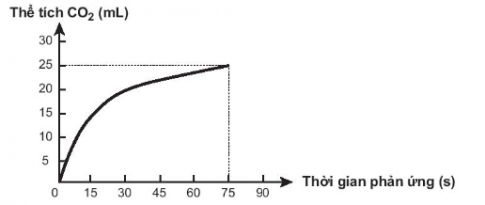
Trong các phát biểu sau, phát biểu nào không đúng?
A. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
B. Tốc độ phản ứng giảm dần theo thời gian.
C. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33 mL/s.
D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
19.26. Thực hiện phản ứng sau:
H2SO4 + Na2S2O3 → Na2SO4 + SO2 + S + H2O
Theo dõi thể tích SO2 thoát ra theo thời gian, ta có bảng sau (thể tích khi được đo ở áp suất khí quyển và nhiệt độ phòng).
Thời gian (s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
Thể tích SO2 (mL) | 0,0 | 12,5 | 20,0 | 26,5 | 31,0 | 32,5 | 33 | 33 |
a) Vẽ đồ thị biểu diễn sự phụ thuộc thể tích khi SO2 vào thời gian phản ứng.
b) Thời điểm đầu, tốc độ phản ứng nhanh hay chậm?
c) Thời điểm kết thúc phản ứng, đồ thị có hình dạng như thế nào?
d) Tính tốc độ trung bình của phản ứng trong khoảng: từ 0 ÷ 10 giây; từ 10 ÷ 20 giây; từ 20 ÷ 40 giây.
19.27. Xét phản ứng sau
2ClO2 + 2NaOH → NaClO3 + NaClO2 + H2O
Tốc độ phản ứng được viết như sau v = k.$C_{ClO_{2}}^{x}.C_{NaOH}^{y}$
Thực hiện phản ứng với những nồng độ chất đầu khác nhau và đo tốc độ phản ứng tương ứng thu được kết quả trong bảng sau
STT | Nồng độ CIO2 (M) | Nồng độ NaOH (M) | Tốc độ phản ứng (mol / (L.s)) |
1 | 0,01 | 0,01 | 2.10$^{-4}$ |
2 | 0,02 | 0,01 | 8.10$^{-4}$ |
3 | 0,01 | 0,02 | 4.10$^{-4}$ |
Hãy tính x và y trong biểu thức tốc độ phản ứng.
19.28. Hãy đề xuất một phương pháp thực nghiệm để nghiên cứu tốc độ các phản ứng sau đây. Trong đó chỉ rõ: đại lượng nào em sẽ đo; đồ thị theo dõi sự thay đổi của đại lượng đó theo thời gian có dạng thế nào.
a) Phản ứng xảy ra trong dung dịch
CH3CH2Br + H2O → CH3CH2OH + HBr
b) Phản ứng xảy ra trong pha khí: 2NO + Cl2 → 2NOCI
19.29. Thực hiện phản ứng:
2ICl + H2 → I2 + 2HCl
Nồng độ đầu của ICl và H2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
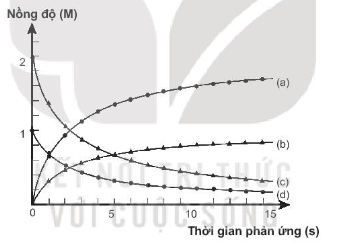
Cho biết các đường (a), (b), (c), (d) tương ứng với sự biến đổi nồng độ các chất nào trong phương trình phản ứng trên. Giải thích.
19.30. Phosgen (COCl2) là một chất độc hoá học được sử dụng trong chiến tranh thế giới thứ nhất. Phản ứng tổng hợp phosgen như sau:
CO + Cl2 → COCl
Biểu thức tốc độ phản ứng có dạng: v = k.$C_{CO}.C_{Cl_{2}}^{3/2}$
Tốc độ phản ứng thay đổi như nào nếu
a) Tăng nồng độ CO lên 2 lần.
b) Giảm nồng độ Cl2 xuống 4 lần.
19.31. Cho phản ứng hoá học sau:
Zn(s) + H2SO4 (aq) → ZnSO4 (aq) + H2 (g)
a) Ở nhiệt độ phòng, đo được sau 1 phút có 7,5 mL khí hydrogen thoát ra. Tính tốc độ trung bình của phản ứng theo hydrogen.
b) Ở nhiệt độ thấp, tốc độ phản ứng là 3 mL/min. Hãy tính xem sau bao lâu thì thu được 7,5 mL khí hydrogen.
19.32. Khi nhiệt độ phòng là 25°C, cho 10 g đá vôi (dạng viên) vào cốc đựng 100g dung dịch HCl loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau 1 phút. Lặp lại thí nghiệm khi nhiệt độ phòng là 35°C. Kết quả thí nghiệm được ghi trong bảng sau:
STT | Nhiệt độ (°C) | Khối lượng cốc (g) | |
Thời điểm đầu | Sau 1 phút | ||
1 | 25 | 235,40 | 235,13 |
2 | 35 | 235,78 | 235,21 |
a) Tính hệ số nhiệt độ của phản ứng.
b) Giả sử ban đầu cốc chứa dung dịch HCl và đá vôi có khối lượng 235,40 g. Thực hiện thí nghiệm ở 45°C. Hỏi sau 1 phút, khối lượng cốc là bao nhiêu? (Bỏ qua khối lượng nước bay hơi).
19.33. Có hai miếng iron có kích thước giống hệt nhau, một miếng là khối iron đặc (A), một miếng có nhiều lỗ nhỏ li ti bên trong và trên bề mặt (B). Thả hai miếng iron vào hai cốc đựng dung dịch HCl cùng thể tích và nồng độ, theo dõi thể tích khi hydrogen thoát ra theo thời gian. Vẽ đồ thị thể tích khi theo thời gian, thu được hai đồ thị sau:

Cho biết đồ thị nào mô tả tốc độ thoát khí từ miếng sắt A, miếng sắt B. Giải thích.
19.34. Xúc tác có hiệu quả cao là xúc tác làm tăng nhanh tốc độ phản ứng. Hai chất MnO2 và Fe2O3 đều có khả năng xúc tác cho phản ứng phân huỷ H2O2.
Đo nồng độ H2O2 theo thời gian, thu được đồ thị sau:

Cho biết xúc tác nào có hiệu quả hơn. Giải thích.
19.35. Khí oxygen và hydrogen có thể cùng tồn tại trong một bình kín ở điều kiện bình thường mà không nguy hiểm. Nhưng khi có tia lửa điện hoặc một ít bột kim loại được thêm vào bình thì lập tức có phản ứng mãnh liệt xảy ra và có thể gây nổ.
a) Tia lửa điện có phải chất xúc tác không? Giải thích.
b) Bột kim loại có phải chất xúc tác không? Giải thích.
Giải bài tập sách giáo khoa (SGK) 10 Kết nối tri thức
- Soạn văn lớp 10 tập 1 kết nối tri thức
- Soạn văn lớp 10 tập 2 kết nối tri thức
- Văn mẫu lớp 10 kết nối tri thức
- Giải bài tập toán lớp 10 tập 1 kết nối tri thức
- Giải bài tập toán lớp 10 tập 2 kết nối tri thức
- Giải bài tập vật lí lớp 10 kết nối tri thức
- Giải bài tập hóa học lớp 10 kết nối tri thức
- Giải bài tập sinh học lớp 10 kết nối tri thức
- Giải bài tập Địa lí lớp 10 kết nối tri thức
- Giải bài tập lịch sử lớp 10 kết nối tri thức
- Giải bài tập tin học lớp 10 kết nối tri thức
- Giải bài tập Âm nhạc lớp 10 kết nối tri thức
- Giải bài tập mĩ thuật lớp 10 kết nối tri thức
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 kết nối tri thức
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 kết nối tri thức
- Giải bài tập hoạt động trải nghiệm lớp 10 kết nối tri thức
- Giải bài tập thiết kế công nghệ lớp 10 kết nối tri thức
- Giải bài tập công nghệ trồng trọt lớp 10 kết nối tri thức
- Giải bài tập giáo dục thể chất lớp 10 kết nối tri thức
- Giải bài tập tiếng anh lớp 10 Global Success
Giải bài tập sách giáo khoa (SGK) 10 Chân trời sáng tạo
- Soạn văn lớp 10 tập 1 chân trời sáng tạo
- Soạn văn lớp 10 tập 2 chân trời sáng tạo
- Văn mẫu lớp 10 chân trời sáng tạo
- Giải bài tập toán lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập toán lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập vật lí lớp 10 chân trời sáng tạo
- Giải bài tập hóa học lớp 10 chân trời sáng tạo
- Giải bài tập sinh học lớp 10 chân trời sáng tạo
- Giải bài tập Địa lí lớp 10 chân trời sáng tạo
- Giải bài tập lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập tin học lớp 10 chân trời sáng tạo
- Giải bài tập Âm nhạc lớp 10 chân trời sáng tạo
- Giải bài tập mĩ thuật lớp 10 chân trời sáng tạo
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập Hoạt động trải nghiệm, hướng nghiệp lớp 10 chân trời sáng tạo bản 1
- Giải bài tập Hoạt động trải nghiệm, hướng nghiệp lớp 10 chân trời sáng tạo bản 2
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 chân trời sáng tạo
- Giải bài tập thiết kế công nghệ lớp 10 chân trời sáng tạo
- Giải bài tập công nghệ trồng trọt lớp 10 chân trời sáng tạo
- Giải bài tập giáo dục thể chất lớp 10 chân trời sáng tạo
- Giải bài tập tiếng anh lớp 10 Friends Global
Giải bài tập sách giáo khoa (SGK) 10 Cánh diều
- Soạn văn lớp 10 tập 1 cánh diều
- Soạn văn lớp 10 tập 2 cánh diều
- Văn mẫu lớp 10 cánh diều
- Giải bài tập toán lớp 10 tập 1 cánh diều
- Giải bài tập toán lớp 10 tập 2 cánh diều
- Giải bài tập vật lí lớp 10 cánh diều
- Giải bài tập hóa học lớp 10 cánh diều
- Giải bài tập sinh học lớp 10 cánh diều
- Giải bài tập Địa lí lớp 10 cánh diều
- Giải bài tập lịch sử lớp 10 cánh diều
- Giải bài tập tin học lớp 10 cánh diều
- Giải bài tập Âm nhạc lớp 10 cánh diều
- Giải bài tập mĩ thuật lớp 10 cánh diều
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 cánh diều
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 cánh diều
- Giải bài tập hoạt động trải nghiệm lớp 10 cánh diều
- Giải bài tập thiết kế công nghệ lớp 10 cánh diều
- Giải bài tập công nghệ trồng trọt lớp 10 cánh diều
- Giải bài tập giáo dục thể chất lớp 10 cánh diều
- Giải bài tập tiếng anh lớp 10 Explore new worlds
Giải bài tập sách bài tập (SBT) lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 kết nối tri thức
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 kết nối tri thức
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) tin học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Global success
Giải bài tập sách bài tập (SBT) lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 chân trời sáng tạo bản 1
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 chân trời sáng tạo bản 2
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Friends Global
Giải bài tập sách bài tập (SBT) lớp 10 Cánh diều
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 cánh diều
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 cánh diều
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) tin học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Explore new world
Giải bài tập chuyên đề học tập 10 Kết nối tri thức
- Giải bài tập chuyên đề toán lớp 10 kết nối tri thức
- Giải bài tập chuyên đề ngữ văn lớp 10 kết nối tri thức
- Giải bài tập chuyên đề vật lí lớp 10 kết nối tri thức
- Giải bài tập chuyên đề hóa học lớp 10 kết nối tri thức
- Giải bài tập chuyên đề sinh học lớp 10 kết nối tri thức
- Giải bài tập chuyên đề lịch sử lớp 10 kết nối tri thức
- Giải bài tập chuyên đề địa lí lớp 10 kết nối tri thức
- Giải bài tập chuyên đề công nghệ trồng trọt lớp 10 kết nối tri thức
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 kết nối tri thức
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng tin học ứng dụng kết nối tri thức
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng khoa học máy tính kết nối tri thức
- Giải bài tập chuyên đề mĩ thuật lớp 10 kết nối tri thức
Giải bài tập chuyên đề học tập 10 Chân trời sáng tạo
- Giải bài tập chuyên đề toán lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề ngữ văn lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề vật lí lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề hóa học lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề sinh học lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề địa lí lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề âm nhạc lớp 10 chân trời sáng tạo
Giải bài tập chuyên đề học tập 10 Cánh diều
- Giải bài tập chuyên đề toán lớp 10 cánh diều
- Giải bài tập chuyên đề ngữ văn lớp 10 cánh diều
- Giải bài tập chuyên đề vật lí lớp 10 cánh diều
- Giải bài tập chuyên đề hóa học lớp 10 cánh diều
- Giải bài tập chuyên đề sinh học lớp 10 cánh diều
- Giải bài tập chuyên đề địa lí lớp 10 cánh diều
- Giải bài tập chuyên đề lịch sử lớp 10 cánh diều
- Giải bài tập chuyên đề công nghệ trồng trọt lớp 10 cánh diều
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 cánh diều
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng tin học ứng dụng cánh diều
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng khoa học máy tính cánh diều
- Giải bài tập chuyên đề âm nhạc lớp 10 cánh diều





