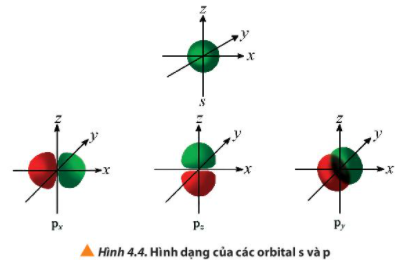
Câu 4. Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (px, py, pz)
Câu hỏi:
Câu 4. Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (px, py, pz)
Câu trả lời:
Người trả lời: GV. Đỗ Thị Vương
Cách 1: 1. Để so sánh các orbital p (px, py, pz), ta cần quan sát hình dạng của chúng.2. Orbital px có dạng hình số tám hướng theo trục x, orbital py hướng theo trục y và orbital pz hướng theo trục z.3. Tất cả các orbital p đều có dạng hình số tám.4. Như vậy, điểm giống nhau giữa các orbital p là dạng hình số tám, điểm khác nhau là hướng của orbital từ trục x, y và z.Cách 2:1. Để so sánh các orbital p (px, py, pz), ta cần so sánh dạng hình và hướng của chúng.2. Các orbital p (px, py, pz) đều có dạng hình số tám, tuy nhiên, orbital px hướng theo trục x, py hướng theo trục y và pz hướng theo trục z.3. Do đó, điểm giống nhau giữa các orbital p là dạng hình số tám, điểm khác nhau là hướng của orbital trên trục x, y và z.Câu trả lời chi tiết hơn:Câu 4: Điểm giống và khác nhau giữa các orbital p (px, py, pz)Điểm giống: tất cả các orbital p (px, py, pz) đều có dạng hình số tám.Điểm khác nhau: - Orbital px có dạng hình số tám hướng theo trục x.- Orbital py có dạng hình số tám hướng theo trục y.- Orbital pz có dạng hình số tám hướng theo trục z.
Câu hỏi liên quan:
- Câu hỏi bổ sungHệ Mặt Trời hôm Mặt Trời ở trung tâm và các thiên thể quay quanh theo những quỹ đạo...
- Câu 2:Quan sát Hình 4.3, phân biết khái niệm đám mây electron và khái niệm orbital nguyên tử
- Câu 3:Cho biết khái niệm orbital nguyên tử xuất phát từ mô hình nguyên tử của Rutherford -...
- II. Lớp và phân lớp electronCâu 5:Quan sát hình 4.5, nhận xét cách gọi tên các lớp electron...
- Câu 6:Từ hình 4.5, cho biết lực hút của hạt nhân với electron ở lớp nào là lớn nhất và lớp...
- Câu 7:Quan sát Hình 4.6, nhận xét về số lượng phân lớp trong các lớp từ 1 đến 4
- III. Cấu hình electron nguyên tửCâu 8:Quan sát Hình 4.7, nhận xét chiều tăng năng lượng của...
- Câu 9:Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở...
- Câu 10:Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi vào...
- Câu 11:Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi...
- Câu hỏi bổ sung 1 :Nguyên tử nitrogen có 2 lớp electron trong đó có 2 phân lớp s và 1 phân...
- Câu 12:Quan sát Hình 4.10, hãy nhận xét số lượng electron độc thân ở mỗi trường hợp
- Câu 13:Hãy đề nghị cách phân bố electron vào các orbial để số electron độc thân là tối đa
- Câu hỏi bổ sung 2Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố electron...
- Câu 14:Cấu hình electron của một nguyên tử cho biết những thông tin gì?
- Câu hỏi bổ sung 3Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu...
- Câu 15:Quan sát Bảng 4.2, hãy cho biết dựa trên cơ sở nào để dự đoán phosphorus là nguyên tố...
- Câu hỏi bổ sung 3Lithium là một nguyên tố có nhiều công dụng, được sử dụng trong chế tạo máy...
- Bài tậpCâu 1:Trong các cách biểu diễn electron vào các orbital của phần lớp 2p ở trạng thái...
- Câu 2:Cho nguyên tố X có 2 lớp eletron, lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử...
- Câu 3:Ở trạng thái cơ bản, nguyên tủ của những nguyên tố nào dưới đây có electron độc thân?a)...
- Câu 4:Viết cấu hình electron nguyên tử của các nguyên tố: carbon ( Z=6), sodium (Z=11) và...






Ngoài ra, các orbital p cũng có hình dạng khác nhau: px có hình dạng giống như hình dễ góc vuông, py giống như hình vòi sen chữ X, còn pz giống như hình vòi sen dọc.
Điểm khác nhau giữa các orbital p (px, py, pz) là hướng xác định của mỗi orbital. Orbital px chỉ nằm theo trục x, orbital py chỉ nằm theo trục y và orbital pz chỉ nằm theo trục z.
Điểm giống giữa các orbital p (px, py, pz) là chúng đều có hình dạng dạng hình cỡ điện tử có dạng tam giác kép và có cùng năng lượng.