Câu 2:Quan sát Hình 4.3, phân biết khái niệm đám mây electron và khái niệm orbital nguyên tử
Câu hỏi:
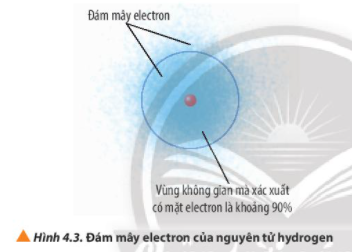
Câu 2: Quan sát Hình 4.3, phân biết khái niệm đám mây electron và khái niệm orbital nguyên tử
Câu trả lời:
Người trả lời: GV. Đỗ Thị Đạt
Cách làm:Bước 1: Quan sát Hình 4.3 để hiểu rõ về cấu trúc của nguyên tử và vị trí của electron.Bước 2: Phân biệt khái niệm đám mây electron và khái niệm orbital nguyên tử dựa trên hiểu biết về cách mà electron tồn tại và chuyển động quanh hạt nhân.Bước 3: So sánh sự khác nhau giữa đám mây electron và orbital nguyên tử.Câu trả lời:- Đám mây nguyên tử được tạo thành khi các electron chuyển động rất nhanh xung quanh hạt nhân với xác suất tìm thấy không giống nhau. Đám mây electron biểu thị vùng không gian có khả năng có mặt của electron xung quanh hạt nhân nguyên tử.- Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron khoảng 90%. Orbital nguyên tử biểu thị không gian mà có khả năng cao tìm thấy electron trong một nguyên tử nhất định.Như vậy, đám mây electron và orbital nguyên tử đều liên quan đến vùng không gian xung quanh hạt nhân nguyên tử mà electron có thể tồn tại, tuy nhiên chúng có sự khác biệt về cách thức biểu diễn và xác suất tìm thấy electron trong không gian đó.
Câu hỏi liên quan:
- Câu hỏi bổ sungHệ Mặt Trời hôm Mặt Trời ở trung tâm và các thiên thể quay quanh theo những quỹ đạo...
- Câu 3:Cho biết khái niệm orbital nguyên tử xuất phát từ mô hình nguyên tử của Rutherford -...
- Câu 4. Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (px, py, pz)
- II. Lớp và phân lớp electronCâu 5:Quan sát hình 4.5, nhận xét cách gọi tên các lớp electron...
- Câu 6:Từ hình 4.5, cho biết lực hút của hạt nhân với electron ở lớp nào là lớn nhất và lớp...
- Câu 7:Quan sát Hình 4.6, nhận xét về số lượng phân lớp trong các lớp từ 1 đến 4
- III. Cấu hình electron nguyên tửCâu 8:Quan sát Hình 4.7, nhận xét chiều tăng năng lượng của...
- Câu 9:Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở...
- Câu 10:Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi vào...
- Câu 11:Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi...
- Câu hỏi bổ sung 1 :Nguyên tử nitrogen có 2 lớp electron trong đó có 2 phân lớp s và 1 phân...
- Câu 12:Quan sát Hình 4.10, hãy nhận xét số lượng electron độc thân ở mỗi trường hợp
- Câu 13:Hãy đề nghị cách phân bố electron vào các orbial để số electron độc thân là tối đa
- Câu hỏi bổ sung 2Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố electron...
- Câu 14:Cấu hình electron của một nguyên tử cho biết những thông tin gì?
- Câu hỏi bổ sung 3Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu...
- Câu 15:Quan sát Bảng 4.2, hãy cho biết dựa trên cơ sở nào để dự đoán phosphorus là nguyên tố...
- Câu hỏi bổ sung 3Lithium là một nguyên tố có nhiều công dụng, được sử dụng trong chế tạo máy...
- Bài tậpCâu 1:Trong các cách biểu diễn electron vào các orbital của phần lớp 2p ở trạng thái...
- Câu 2:Cho nguyên tố X có 2 lớp eletron, lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử...
- Câu 3:Ở trạng thái cơ bản, nguyên tủ của những nguyên tố nào dưới đây có electron độc thân?a)...
- Câu 4:Viết cấu hình electron nguyên tử của các nguyên tố: carbon ( Z=6), sodium (Z=11) và...






Đám mây electron không xác định được chính xác vị trí của electron, trong khi orbital nguyên tử cho biết vị trí cụ thể của electron tương đối chính xác.
Đám mây electron mô tả vùng không gian xác suất chứa electron, trong khi orbital nguyên tử chỉ nhấn mạnh vào khu vực chứa electron có xác suất cao.
Orbital nguyên tử là khu vực không gian cụ thể và biết định nơi electron có khả năng tìm thấy nhiều nhất xung quanh hạt nhân nguyên tử.
Đám mây electron là một khu vực không gian xác suất có khả năng chứa electron xung quanh hạt nhân nguyên tử.