CHƯƠNG 1: CẤU TẠO NGUYÊN TỬ
CHƯƠNG 2: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN
- Giải bài tập 5 Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Giải bài tập 6 Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
- Giải bài tập 7 Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
- Giải bài tập 8 Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Giải bài tập 9 Ôn tập chương 2
CHƯƠNG 3: LIÊN KẾT HÓA HỌC
CHƯƠNG 4: PHẢN ỨNG OXI HÓA- KHỬ
CHƯƠNG 5: NĂNG LƯỢNG HÓA HỌC
CHƯƠNG 6: TỐC ĐỘ PHẢN ỨNG
CHƯƠNG 7: NGUYÊN TỐ NHÓM HALOGEN
Giải bài tập 19 Tốc độ phản ứng
https://s.shopee.vn/AKN2JyAJAw
Giải bài tập 19 Tốc độ phản ứng trong sách Hóa học lớp 10
Bài tập 19 về tốc độ phản ứng trong sách Hóa học lớp 10 giúp học sinh hiểu rõ về quá trình phản ứng hóa học và cách đo lường tốc độ của chúng. Mỗi bài tập được giải chi tiết, kèm theo đáp án chuẩn và hướng dẫn cụ thể, giúp học sinh nắm vững kiến thức bài học.
Trong bài tập này, câu hỏi đầu tiên yêu cầu học sinh xem xét sự thay đổi nồng độ của một chất trong phản ứng H2+Cl2→2HCl theo thời gian. Đồ thị nêu rõ sự thay đổi này với chất HCl. Đơn vị của tốc độ phản ứng được đề cập là mol/L.min, giúp học sinh hiểu rõ cách đo lường tốc độ phản ứng trong trường hợp cụ thể này.
Với sự hướng dẫn chi tiết và dễ hiểu, bài tập 19 Tốc độ phản ứng trong sách Hóa học lớp 10 là nguồn tư liệu hữu ích cho học sinh ôn tập và nắm vững kiến thức về tốc độ phản ứng hóa học.
Bài tập và hướng dẫn giải
Câu 2. Cho phản ứng của các chất ở thể khí:
2NO+2H2→N2+2H2O
Hãy viết biểu thức tốc độ trung bình theo sự biến đổi nồng độ chất đầu và chất sản phẩm của phản ứng trên.
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng
Câu 3. Cho phản ứng của các chất ở thể tích khí: I2+H2 $\rightarrow ^{}$2HI.
Biết tốc độ phản ứng tỉ lệ thuận với nồng độ của các chất tham gia phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
a) Hãy viết phương trình tốc độ của phản ứng này.
b) Ở một nhiệt độ xác định, hằng số tốc độ phản ứng này là 2,5.10-4L/(mol.s). Nồng độ đầu của I2 và H2 lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:
- Tại thời điểm đầu.
- Tại thời điểm đã hết một nửa lượng I2.
Câu 4. Nêu mối liên hệ giữa nồng độ và áp suất của khí trong hỗn hợp
Câu 5. Áp suất ảnh hưởng đến tốc độ phản ứng nào sau đây?
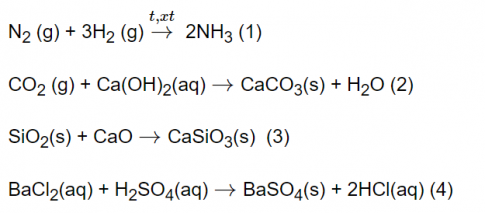
Câu 6. Hãy giải thích tại sao khi nhiệt độ tăng thì tốc độ phản ứng tăng
Câu 7. Nêu ý nghĩa của hệ số nhiệt độ Van’t Hof.
Câu 8. Ở 20oC, tốc độ một phản ứng là 0,05 mol/(L.min). Ở 30oC, tốc độ phản ứng này là 0,15 mol/(L.min).
a) Hãy tính hệ số nhiệt độ Van’t Hof của phản ứng trên.
b) Dự đoán tốc độ phản ứng trên ở 40oC (giả thiết hệ số nhiệt độ γ trong khoảng nhiệt độ này không đổi).
Câu 9. Thực hiện hai phản ứng phân hủy H2O2: một phản ứng có xúc tác MnO2, một phản ứng không xúc tác. Đo thể tích khí oxygen theo thời gian và biểu diễn trên đồ thị như hình bên.
Đường phản ứng nào trên đồ thị tương ứng với phản ứng có xúc tác, với phản ứng không có xúc tác?
III. Một số ứng dụng của việc thay đổi tốc dộ phản ứng
Câu 10. Yếu tố nào đã được áp dụng để làm thay đổi tốc độ của các phản ứng trong hình 19.7?
Câu 11. Phản ứng tạo NO từ NH3 là một giai đoạn trung gian trong quá trình sản xuất nitric acid: 4NH3(g) + 5O2(g) → 4NO(g) + 6 H2O(g)
Hãy nêu một số cách để tăng tốc độ phản ứng này.
Giải bài tập sách giáo khoa (SGK) 10 Kết nối tri thức
- Soạn văn lớp 10 tập 1 kết nối tri thức
- Soạn văn lớp 10 tập 2 kết nối tri thức
- Văn mẫu lớp 10 kết nối tri thức
- Giải bài tập toán lớp 10 tập 1 kết nối tri thức
- Giải bài tập toán lớp 10 tập 2 kết nối tri thức
- Giải bài tập vật lí lớp 10 kết nối tri thức
- Giải bài tập hóa học lớp 10 kết nối tri thức
- Giải bài tập sinh học lớp 10 kết nối tri thức
- Giải bài tập Địa lí lớp 10 kết nối tri thức
- Giải bài tập lịch sử lớp 10 kết nối tri thức
- Giải bài tập tin học lớp 10 kết nối tri thức
- Giải bài tập Âm nhạc lớp 10 kết nối tri thức
- Giải bài tập mĩ thuật lớp 10 kết nối tri thức
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 kết nối tri thức
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 kết nối tri thức
- Giải bài tập hoạt động trải nghiệm lớp 10 kết nối tri thức
- Giải bài tập thiết kế công nghệ lớp 10 kết nối tri thức
- Giải bài tập công nghệ trồng trọt lớp 10 kết nối tri thức
- Giải bài tập giáo dục thể chất lớp 10 kết nối tri thức
- Giải bài tập tiếng anh lớp 10 Global Success
Giải bài tập sách giáo khoa (SGK) 10 Chân trời sáng tạo
- Soạn văn lớp 10 tập 1 chân trời sáng tạo
- Soạn văn lớp 10 tập 2 chân trời sáng tạo
- Văn mẫu lớp 10 chân trời sáng tạo
- Giải bài tập toán lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập toán lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập vật lí lớp 10 chân trời sáng tạo
- Giải bài tập hóa học lớp 10 chân trời sáng tạo
- Giải bài tập sinh học lớp 10 chân trời sáng tạo
- Giải bài tập Địa lí lớp 10 chân trời sáng tạo
- Giải bài tập lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập tin học lớp 10 chân trời sáng tạo
- Giải bài tập Âm nhạc lớp 10 chân trời sáng tạo
- Giải bài tập mĩ thuật lớp 10 chân trời sáng tạo
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập Hoạt động trải nghiệm, hướng nghiệp lớp 10 chân trời sáng tạo bản 1
- Giải bài tập Hoạt động trải nghiệm, hướng nghiệp lớp 10 chân trời sáng tạo bản 2
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 chân trời sáng tạo
- Giải bài tập thiết kế công nghệ lớp 10 chân trời sáng tạo
- Giải bài tập công nghệ trồng trọt lớp 10 chân trời sáng tạo
- Giải bài tập giáo dục thể chất lớp 10 chân trời sáng tạo
- Giải bài tập tiếng anh lớp 10 Friends Global
Giải bài tập sách giáo khoa (SGK) 10 Cánh diều
- Soạn văn lớp 10 tập 1 cánh diều
- Soạn văn lớp 10 tập 2 cánh diều
- Văn mẫu lớp 10 cánh diều
- Giải bài tập toán lớp 10 tập 1 cánh diều
- Giải bài tập toán lớp 10 tập 2 cánh diều
- Giải bài tập vật lí lớp 10 cánh diều
- Giải bài tập hóa học lớp 10 cánh diều
- Giải bài tập sinh học lớp 10 cánh diều
- Giải bài tập Địa lí lớp 10 cánh diều
- Giải bài tập lịch sử lớp 10 cánh diều
- Giải bài tập tin học lớp 10 cánh diều
- Giải bài tập Âm nhạc lớp 10 cánh diều
- Giải bài tập mĩ thuật lớp 10 cánh diều
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 cánh diều
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 cánh diều
- Giải bài tập hoạt động trải nghiệm lớp 10 cánh diều
- Giải bài tập thiết kế công nghệ lớp 10 cánh diều
- Giải bài tập công nghệ trồng trọt lớp 10 cánh diều
- Giải bài tập giáo dục thể chất lớp 10 cánh diều
- Giải bài tập tiếng anh lớp 10 Explore new worlds
Giải bài tập sách bài tập (SBT) lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 kết nối tri thức
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 kết nối tri thức
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) tin học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Global success
Giải bài tập sách bài tập (SBT) lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 chân trời sáng tạo bản 1
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 chân trời sáng tạo bản 2
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Friends Global
Giải bài tập sách bài tập (SBT) lớp 10 Cánh diều
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 cánh diều
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 cánh diều
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) tin học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Explore new world
Giải bài tập chuyên đề học tập 10 Kết nối tri thức
- Giải bài tập chuyên đề toán lớp 10 kết nối tri thức
- Giải bài tập chuyên đề ngữ văn lớp 10 kết nối tri thức
- Giải bài tập chuyên đề vật lí lớp 10 kết nối tri thức
- Giải bài tập chuyên đề hóa học lớp 10 kết nối tri thức
- Giải bài tập chuyên đề sinh học lớp 10 kết nối tri thức
- Giải bài tập chuyên đề lịch sử lớp 10 kết nối tri thức
- Giải bài tập chuyên đề địa lí lớp 10 kết nối tri thức
- Giải bài tập chuyên đề công nghệ trồng trọt lớp 10 kết nối tri thức
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 kết nối tri thức
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng tin học ứng dụng kết nối tri thức
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng khoa học máy tính kết nối tri thức
- Giải bài tập chuyên đề mĩ thuật lớp 10 kết nối tri thức
Giải bài tập chuyên đề học tập 10 Chân trời sáng tạo
- Giải bài tập chuyên đề toán lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề ngữ văn lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề vật lí lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề hóa học lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề sinh học lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề địa lí lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề âm nhạc lớp 10 chân trời sáng tạo
Giải bài tập chuyên đề học tập 10 Cánh diều
- Giải bài tập chuyên đề toán lớp 10 cánh diều
- Giải bài tập chuyên đề ngữ văn lớp 10 cánh diều
- Giải bài tập chuyên đề vật lí lớp 10 cánh diều
- Giải bài tập chuyên đề hóa học lớp 10 cánh diều
- Giải bài tập chuyên đề sinh học lớp 10 cánh diều
- Giải bài tập chuyên đề địa lí lớp 10 cánh diều
- Giải bài tập chuyên đề lịch sử lớp 10 cánh diều
- Giải bài tập chuyên đề công nghệ trồng trọt lớp 10 cánh diều
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 cánh diều
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng tin học ứng dụng cánh diều
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng khoa học máy tính cánh diều
- Giải bài tập chuyên đề âm nhạc lớp 10 cánh diều





