Giải bài tập 3 Cấu trúc lớp vỏ electron nguyên tử
Giải bài tập 3: Cấu trúc lớp vỏ electron nguyên tử
Sách "Giải bài tập 3: Cấu trúc lớp vỏ electron nguyên tử" là một tài liệu học hóa học dành cho học sinh lớp 10, giúp họ kết nối tri thức và hiểu rõ hơn về cấu trúc electron trong nguyên tử. Phần đáp án và hướng dẫn giải chi tiết được cung cấp để giúp học sinh nắm vững kiến thức bài học.
Trong mô hình hiện đại, electron trong nguyên tử chuyển động rất nhanh và không theo quỹ đạo xác định. Điều này giúp chúng ta hiểu hơn về sự tổ chức và chuyển động của electron trong nguyên tử.
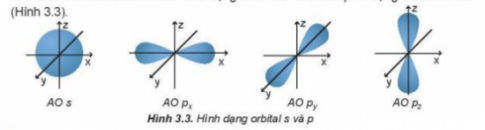
Câu hỏi 2 yêu cầu học sinh nhận diện dạng của orbital s. Đáp án đúng là Hình cầu, cho thấy sự phân bố của electron trong không gian xung quanh hạt nhân nguyên tử.
Đọc sách "Giải bài tập 3: Cấu trúc lớp vỏ electron nguyên tử" sẽ giúp học sinh hiểu rõ hơn về cấu trúc electron và giải quyết các bài tập liên quan đến chủ đề này một cách dễ dàng và chi tiết.
Bài tập và hướng dẫn giải
Câu 3. Quan sát Hình 3.3 và nêu sự định hướng của các AO p trong không gian.
II. Lớp và phân lớp electron
Câu 4. Hãy cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p. b) Phân lớp d.
Câu 5. Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tổng số electron tối đa có trong các lớp L và M là:
A. 2 và 8 B. 8 và 10 C. 8 và 18 D. 18 và 32.
III. Cấu hình electron của nguyên tử
Câu 6. Cấu hình electron của nguyên tử có Z = 16 là:
A. $1S^{2}$ $2S^{2}$ $2P^{6}$ $3S^{2}$ $3P^{3}$
B. $1S^{2}$ $2S^{2}$ $2P^{6}$ $3S^{2}$ $3P^{5}$
C. $1S^{2}$ $2S^{2}$ $2P^{6}$ $3S^{2}$ $3P^{4}$
D. $1S^{2}$ $2S^{2}$ $2P^{5}$ $3S^{2}$ $3P^{4}$
Câu 7. Biểu diễn cấu hình electron của các nguyên tử có Z = 8 và Z = 11 theo ô orbital.
Câu 8. Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, …. Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
Câu 9. Chlorine (Z=17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Viết cấu hình electron của nguyên tử chlorine và cho biết tại sao chlorine là phi kim.
Câu 10. Nguyên tố calcium giúp xương chắc, khỏe. Cấu hình electron lớp ngoài cùng của nguyên tử calcium là $4s^{2}$. Hãy viết cấu hình electron đầy đủ của nguyên tử calcium và cho biết nguyên tố calcium là kim loại, phi kim hay khí hiếm.





