Câu 6. So sánh nhiệt tỏa ra khi đốt cháy hoàn toàn 1kh cồn (C2H5OH) và 1 kg tristearin (C57H110O6,...
Câu hỏi:
Câu 6. So sánh nhiệt tỏa ra khi đốt cháy hoàn toàn 1kh cồn (C2H5OH) và 1 kg tristearin (C57H110O6, có trong mỡ lợn). Cho biết:
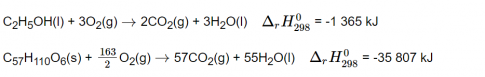
Câu trả lời:
Người trả lời: GV. Đỗ Thị Linh
Cách 1:Để so sánh nhiệt tỏa ra khi đốt cháy hoàn toàn 1kg cồn và 1kg tristearin, ta cần tính năng lượng tỏa ra từ phản ứng cháy của từng chất.1. Tính năng lượng tỏa ra khi đốt cháy 1kg cồn:- Mức độ cặn của cồn (C2H5OH) là 46g/mol.- Số mol cồn trong 1kg = 1000g/46g/mol = 21.74 mol- Năng lượng tỏa ra khi đốt cháy 1 mol C2H5OH là 1367 kJ.- Năng lượng tỏa ra khi đốt cháy 1kg cồn là: 21.74 mol x 1367 kJ/mol = 29751.58 kJ2. Tính năng lượng tỏa ra khi đốt cháy 1kg tristearin:- Mức độ cặn của tristearin (C57H110O6) là 890g/mol.- Số mol tristearin trong 1kg = 1000g/890g/mol = 1.12 mol- Năng lượng tỏa ra khi đốt cháy 1 mol tristearin là 23933 kJ.- Năng lượng tỏa ra khi đốt cháy 1kg tristearin là: 1.12 mol x 23933 kJ/mol = 26832.16 kJDo đó, ta có kết luận nhiệt tỏa ra khi đốt cháy 1kg tristearin lớn hơn nhiệt tỏa ra khi đốt cháy 1kg cồn.Cách 2:Ta sử dụng phương trình tính năng lượng tỏa ra từ phản ứng cháy:Q = nΔHtrong đó:- Q: nhiệt tỏa ra- n: số mol chất đốt- ΔH: nhiệt đốt cháySau khi tính toán cho cả 2 chất, ta sẽ được kết quả như trên.
Câu hỏi liên quan:
- II. Luyện tậpCâu 1. Phản ứng chuyển hóa giữa hai dạng đơn chất của phosohorus (P): ...
- Câu 2: Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:CO(g) + 12O2(g) →...
- Câu 13. Dung dịch glucose ($C_{6}$$H_{12}$$O_{6}$) 5%, có khối lượng riêng là 1,02 g/mL, phản ứng...
- Câu 4. Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:Biến thiên enthalpy của...
- Câu 5. Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:CH4(g) +...
- Câu 7. Biết CH3COCH3có công thức cấu tạo:Từ số liệu năng lượng liên kết ở Bảng 12.2, hãy xác...
- Câu 8. Một bình gas (khí hóa lỏng) chứa hỗn hợp propane và butane với tỉ lệ số mol 1:2.Xác định...






Với cùng một khối lượng 1kg, lượng nhiệt tỏa ra khi đốt cháy tristearin sẽ cao hơn so với cồn vì tristearin có cấu trúc phân tử lớn hơn và cần lượng O2 nhiều hơn để hoàn thành quá trình đốt cháy.
Trong trường hợp này, mỗi mol cồn cần số mol O2 là 3.5 mol, trong khi đó mỗi mol tristearin cần số mol O2 là 255 mol. Vì vậy, nhiệt tỏa ra khi đốt cháy tristearin sẽ lớn hơn nhiệt tỏa ra khi đốt cháy cồn vì cần lượng O2 lớn hơn.
Khi đốt cháy hoàn toàn 1kg cồn (C2H5OH), lượng nhiệt tỏa ra được tính bằng sản phẩm nhiệt của phản ứng hóa học, và phụ thuộc vào số lượng mol của các chất tham gia phản ứng.