OT6.9. Sự phân huỷ H2O2 theo phương trình hoá học:2H2O2(aq) → 2H2O(l) + O2 (g),được nghiên...
Câu hỏi:
OT6.9. Sự phân huỷ H2O2 theo phương trình hoá học:
2H2O2(aq) → 2H2O (l) + O2 (g),
được nghiên cứu và cho kết quả tại một nhiệt độ cụ thể như sau:
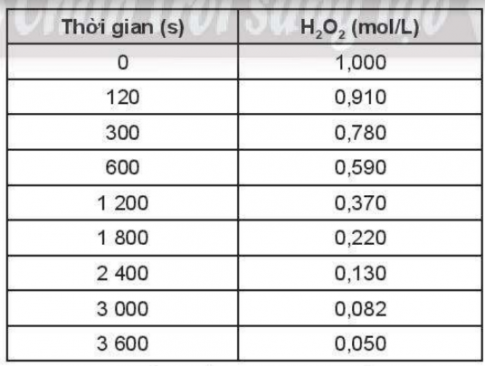
a) Tính tốc độ trung bình của phản ứng phân huỷ H2O2 theo thời gian.
b) Tốc độ phản ứng thay đổi thế nào theo thời gian? Giải thích sự thay đổi đó.
Câu trả lời:
Người trả lời: GV. Đỗ Thị Linh
Để tính tốc độ trung bình của phản ứng phân huỷ H2O2 theo thời gian, chúng ta cần biết sự thay đổi của nồng độ H2O2 theo thời gian để có thể xác định được tốc độ.Cách làm:1. Tính tốc độ phản ứng bằng cách chia độ biến thiên của nồng độ H2O2 theo thời gian cho độ biến thiên của thời gian.2. Lập bảng biểu hiện thị sự thay đổi của nồng độ H2O2 theo thời gian.3. Tính tốc độ phản ứng tại các điểm thời gian khác nhau.4. Vẽ đồ thị nồng độ H2O2 theo thời gian để hình dung sự thay đổi của nồng độ này và cách tốc độ phản ứng thay đổi theo thời gian.Câu trả lời:a) Tốc độ phản ứng phân huỷ H2O2 theo thời gian sẽ giảm dần.b) Tốc độ phản ứng giảm dần theo thời gian do tốc độ phản ứng phụ thuộc vào nồng độ chất tham gia. Khi nồng độ H2O2 giảm dần theo thời gian, tốc độ phản ứng cũng giảm theo. Điều này là do có ít phân tử H2O2 tham gia vào phản ứng nên việc phân huỷ H2O2 trở nên chậm hơn và tốc độ phản ứng giảm theo thời gian.
Câu hỏi liên quan:
- OT6.1. Phản ứng 2NO (g) + O2 (g) → 2NO2 (g) có biểu thức tốc độ tức thời:$v =...
- OT6.2. Nếu mỗi đồ thị có các chất phản ứng cùng nồng độ và trục thời gian thì tốc độ của chất phản...
- OT6.3. Thanh phát sáng là một sản phẩm quen thuộc được dùng giải trí. Đặt 2 thanh phát quang hoá...
- OT6.4. Trong hầu hết các phản ứng hoá học, tốc độ phản ứng tăng khi nhiệt độ tăng. Muốn pha một cốc...
- OT6.5. Cho phương trình hoá học của phản ứng: 2CO (g) + O2 (g) → 2CO2 (g)Với biểu thức tốc độ...
- OT6.6. Từ thí nghiệm ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng trong sách giáo khoa (SGK)...
- OT6.7. Trong phản ứng: A → sản phẩmTại thời điểm t = 0, nồng độ chất A là 0,1563 M, sau 1 phút,...
- OT6.8. Xét phản ứng phân huỷ N2O5 theo phương trình hoá học: N2O5 (g) → 4NO2 (g) + O2 (g), xảy ra ở...
Bình luận (0)





